Leucipo e Demócrito, filósofos gregos criaram o conceito de átomo, como sendo as partículas constituintes do universo, elas eram indivisíveis (A = Não e Tomo = divisível)
2. Modelo atômico de Dalton
John Dalton elaborou o primeiro modelo atômico com base experimental. Segundo o cientista, os átomos eram esferas maciças, indestrutíveis e indivisíveis, por esse motivo, o modelo de Dalton ficou conhecido como Modelo da Bola de Bilhar.
O modelo de Dalton pode ser resumido de acordos com a seguintes afirmativas:
- Toda a matéria é formada por átomos, particulas esféricas, indestrutíveis, indivisíveis e maciças
- Cada elemento possui um tipo único de átomo
- Átomo de um mesmo elemento são iguais
- Átomos de elementos diferentes se diferem na massa
- Uma substância composta é formada por átomos compostos, espécies químicas de diferentes elementos que possuem quantidade fixa.
- Uma reações química é o rearranjo de átomos, mantendo a massa constante.
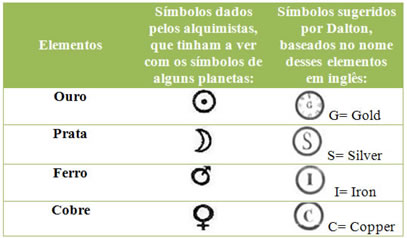 |
| Representação de alguns elementos segundo Dalton em comparação aos alquimistas |
Defeitos: Não explicou a eletricidade e nem a radioatividade (não havia sido descoberta)
3. Modelo de Thomson
Como os átomos são eletricamente neutros, a descoberta do elétron (através da ampola ou tubo de Crookes) fez Thomson sugerir a existência de uma partícula de carga posítiva (já que os elétrons eram negativos). Dessa maneira, Thomson formulou seu modelo para explicar o átomo, uma esfera maciça positiva com elétrons dispersos. Por isso o modelo de Thomson ficou conhecido como Modelo do Pudim de Passas.
Segundo Thomson, o número de elétrons deveria ser suficiente para anular a carga positiva, tornando o átomo neutro. Portanto, quando um átomo perdia um elétron este se tornaria um íon (cátion, no caso), porém a massa do elétron seria desprezível se comparada à do átomo, por isso os íons teriam massa praticamente igual à de sua forma neutra.
4. Modelo de Rutherford
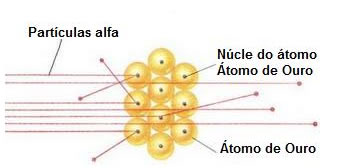
Suas pesquisas se voltaram para os raios alfa (composto por partículas positivas) , ele emitiu esses raios sobre uma fina folha de ouro. Rutherford notou que a grande parte parte das partículas atravessava a folha sem sofrer desvio (99%), 1% sofria um grande desvio, e uma a cada 10 mil colidia com a lamina e era rebatida.
Através dessas observações, Rutherford concluiu que os átomos tinham um núcleo, onde ficavam os prótons de carga positiva, e uma eletrosfera onde ficavam os elétrons. Na eletrosfera os elétrons ficam se movendo em órbita circular ao redor do núcleo que é cerca de 100 mil vezes menor que a eletrosfera além da massa estar toda concentrada nele. Para explicar as massas dos átomos, Rutherford introduziu uma ideia de uma particula neutra no núcleo de massa muito próxima à do próton.
Problema do modelo: como o elétron está em movimento na eletrosfera ele deveria perder energia na forma de radiação fazendo com ele tendesse a se colapsar com o núcleo.
5. Modelo Atômico de Bohr ou Modelo de Rutherford-Bohr
Esse modelo é um aprimoramento do Modelo de Rutherford, por Bohr.
Seus princípios são os seguintes:
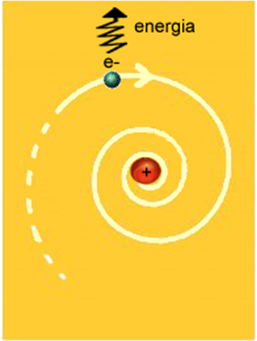
- Os elétrons ocupam determinados níveis de energia ou camadas eletrônicas
- O elétron não pode ter energia zero, ou seja, estar parado no núcleo
- Em cada camada, o elétron possui energia constante: quanto mais próximo do núcleo, menor a energia do elétron com relação ao núcleo e quanto mais distante dele, maior a energia
- Para passar de um nível menor de energia para um de maior energia (salto quântico), o elétron absorve uma quantidade apropriada de energia. Ao voltar para sua camada, ele libera energia na forma de luz. A quantidade absorvida ou liberada de energia corresponde à diferença entre um nível e outro. Como só existem algumas órbitas, só existem alguns valores para a energia, por isso a denominação Energia Quantizada.
(PARA FUNCIONAR PRECISA TER O JAVA INSTALADO NO COMPUTADOR)
Exercícios
1) (URCAMP-RS) Considerando o autor e a ideia, associea 1ª coluna à 2ª:
a) Dalton
b) Rutherford
c) Thomson
( ) modelo atômico planetário
( ) Átomo indivisível
( ) Modelo atômico do pudim de passas
2) (FUVEST-SP) Thomson determinou, pela primeira vez, a relação entre a massa e a carga do elétron, o que pode ser considerado como a descoberta do elétron. É reconhecida como uma contribuição de Thomson ao modelo atômico:
a) átomo ser indestrutível
b) a existência de partículas subatômicas
c) os elétrons ocuparem níveis discretos de energia
d) os elétrons girarem em órbitas circulares ao redor do núcleo
e) o átomo possuir um núcleo com carga positiva e uma eletrosfera
3) (UFRGS editada) Uma moda atual entre as crianças é colecionar figurinhas que brilham no escuro. Essas figurinhas apresentam em sua constituição a substância sulfeto de zinco. O fenômeno ocorre porque alguns elétron que compõe os átomos dessa substância absorvem energia luminosa e saltam para níveis de energia mais externos. No escuro, esses elétrons retornam aos seus níveis de origem, liberando energia luminosa fazendo a figurinha brilhar. Essa característica pode ser explicada considerando o modelo atômico proposto por:
a) Dalton
b) Thomson
c) Rutherford
d) Bohr
e) Índio tupi das 3 linguas
4) (UFJF-MG) Associe as afirmações a seus respectivos responsáveis:
I- O átomo não é indivisível e a matéria possui propriedades elétricas (1897).
II- O átomo é uma esfera maciça (1808).
III- O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911).
a) I - Dalton, II - Rutherford, III - Thomson.
b) I - Thomson, II - Dalton, III - Rutherford.
c) I - Dalton, II - Thomson, III - Rutherford.
d) I - Rutherford, II - Thomson, III - Dalton.
e) I - Thomson, II - Rutherford, III - Dalton.
II- O átomo é uma esfera maciça (1808).
III- O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911).
a) I - Dalton, II - Rutherford, III - Thomson.
b) I - Thomson, II - Dalton, III - Rutherford.
c) I - Dalton, II - Thomson, III - Rutherford.
d) I - Rutherford, II - Thomson, III - Dalton.
e) I - Thomson, II - Rutherford, III - Dalton.
5) (UFMG) Ao resumir as características de cada um dos sucessivos modelos do átomo de hidrogênio, um estudante elaborou o seguinte resumo:
Modelo Atômico: Dalton
Características: Átomos maciços e indivisíveis.
Modelo Atômico: Thomson
Características: elétron, de carga negativa, incrustado em uma esfera de carga positiva. A carga positiva está distribuída, homogeneamente, por toda a esfera.
Modelo Atômico: Rutherford
Características: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Não há restrição quanto aos valores dos raios das órbitas e das energias do elétron.
Modelo Atômico: Bohr
Características: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Apenas certos valores dos raios das órbitas e das energias do elétron são possíveis.
Características: Átomos maciços e indivisíveis.
Modelo Atômico: Thomson
Características: elétron, de carga negativa, incrustado em uma esfera de carga positiva. A carga positiva está distribuída, homogeneamente, por toda a esfera.
Modelo Atômico: Rutherford
Características: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Não há restrição quanto aos valores dos raios das órbitas e das energias do elétron.
Modelo Atômico: Bohr
Características: elétron, de carga negativa, em órbita em torno de um núcleo central, de carga positiva. Apenas certos valores dos raios das órbitas e das energias do elétron são possíveis.
O número de erros cometidos pelo estudante é:
a) 0
b) 1
c) 2
d) 3
b) 1
c) 2
d) 3
6) Assinale a alternativa que completa melhor os espaços apresentados na frase abaixo:
“O modelo de Rutherford propõe que o átomo seria composto por um núcleo muito pequeno e de carga elétrica ..., que seria equilibrado por …, de carga elétrica …, que ficavam girando ao redor do núcleo, numa região periférica denominada ...”
a) neutra, prótons, positiva e núcleo.
b) positiva, elétrons, positiva, eletrosfera.
c) negativa, prótons, negativa, eletrosfera.
d) positiva, elétrons, negativa, eletrosfera.
e) negativa, prótons, negativa, núcleo
b) positiva, elétrons, positiva, eletrosfera.
c) negativa, prótons, negativa, eletrosfera.
d) positiva, elétrons, negativa, eletrosfera.
e) negativa, prótons, negativa, núcleo
7) Em relação ao modelo atômico de Rutherford, julgue os itens a seguir como verdadeiros ou falsos:
a) Esse modelo baseia-se em experimentos com eletrólise de soluções de sais de ouro.
b) Ele apresenta a matéria constituída por elétrons em contato direto com os prótons.
c) O modelo foi elaborado a partir de experimentos em que uma fina lâmina de ouro era bombardeada com partículas α.
d) Segundo esse modelo, só é permitido ao elétron ocupar níveis energéticos nos quais ele se apresenta com valores de energia múltiplos inteiros de um fóton.
e) Esse modelo é semelhante a um sistema planetário, em que os elétrons distribuem-se ao redor do núcleo, assim como os planetas em torno do Sol.
8) (ESPM-SP) O átomo de Rutherford (1911) foi comparado ao sistema planetário (o núcleo atômico representa o sol e a eletrosfera, os planetas):
Eletrosfera é a região do átomo que:
a) contém as partículas de carga elétrica negativa.
b) contém as partículas de carga elétrica positiva.
c) contém nêutrons.
d) concentra praticamente toda a massa do átomo.
e) contém prótons e nêutrons.
9) Abaixo você tem a relação de algumas características atômicas, especifique o cientista responsável por cada uma destas teorias:
I. O átomo é comparado a uma bola de bilhar: uma esfera maciça, homogênea, indivisível, indestrutível e eletricamente neutra.
II. O átomo é comparado a um pudim de ameixas: uma esfera carregada positivamente e que elétrons de carga negativa ficam incrustados nela.
III. Átomo em que os elétrons se organizam na forma de camadas ao redor do núcleo.
IV. Átomo que apresenta um núcleo carregado positivamente e ao seu redor gira elétrons com carga negativa.
10) O primeiro modelo científico para o átomo foi proposto por Dalton em 1808. Este modelo foi comparado a:
a) Uma bola de tênis;
b) Uma bola de futebol;
c) Uma bola de pingue-pongue;
d) Uma bola de bilhar;
e) Uma bexiga cheia de ar.
GABARITO
1- E
2-B
3-D
4-B
5-A
6-D
7-F,F,V,F,V
8-A
9-I(Dalton), II(Thomson), III(Bohr) e IV(Rutherford)
10-D


Nenhum comentário:
Postar um comentário